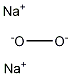
名称:过氧化钠
英文名称:Sodium peroxide
分子式:Na2O2
分子量:77.98 g/mol
标签:Sodium superoxide,Sodium dioxide,过氧化碱,超氧化钠,氧化剂,防腐剂,除臭剂,杀菌剂,漂白剂
编号系统
1313-60-6
MFCD00003497
215-209-4
WD3450000
暂无
24886315
物性数据
1.性状:米黄色粉末或颗粒,加热则变为黄色,有吸湿性。[1]
2.熔点(分解,℃):460[2]
3.沸点(分解,℃):657[3]
4.相对密度(水=1):2.80[4]
5.溶解性:溶于水,溶于酸,不溶于碱。[5]
毒理学数据
1.急性毒性 暂无资料
2.刺激性 暂无资料
生态学数据
1.对是水稍微有危害的不要让未稀释或大量的产品接触地下水、水道或者污水系统,若无政府许可,勿将材料排入周围环境。
2.生态毒性 暂无资料
3.生物降解性 暂无资料
4.非生物降解性 暂无资料
分子结构数据
1、摩尔折射率:无可用的
2、摩尔体积(cm3/mol):无可用的
3、等张比容(90.2K):无可用的
4、表面张力(dyne/cm):无可用的
5、介电常数:无可用的
6、极化率:无可用的
7、单一同位素质量:77.969369 Da
8、标称质量:78 Da
9、平均质量:77.9783 Da
计算化学数据
1.疏水参数计算参考值(XlogP):无
2.氢键供体数量:0
3.氢键受体数量:2
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积46.1
7.重原子数量:4
8.表面电荷:0
9.复杂度:4
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:3
性质与稳定性
1.在空气中吸收水分和二氧化碳。与水发生剧烈反应。对呼吸系统和皮肤有刺激性。加热至460℃分解。溶于稀酸,不溶于碱,在醇和氨中分解放出氧。有吸湿性,在空气中吸收水分和二氧化碳生成氢氧化物和碳酸盐。它本身虽不会燃烧或爆炸,但与易氧化的有机物或无机物混合能发火燃烧或爆炸。与水猛烈作用产生大量的热而引起火灾。有强烈的腐蚀性,是一种强氧化剂。工作人员操作时应穿戴劳保防护用具。灼烧至红热分解并放出氧气。
2.稳定性[6] 稳定
3.禁配物[7] 强还原剂、水、酸类、易燃或可燃物、醇类、二氧化碳、硫黄、活性金属粉末
4.避免接触的条件[8] 摩擦、潮湿空气
5.聚合危害[9] 不聚合
6.分解产物[10] 氧气、氧化钠
贮存方法
储存注意事项[11] 储存于阴凉、干燥、通风良好的专用库房内,远离火种、热源。库温不超过30℃,相对湿度不超过75%。包装密封。注意防潮和雨淋。应与还原剂、酸类、醇类、活性金属粉末等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
合成方法
1.金属钠氧化法 将熔融金属钠预热至180℃以上,向氧化炉中喷入压力为39.2~44.1Pa的高速压缩空气流,在300~350℃使钠氧化燃烧,生成的过氧化钠经自由沉降逐渐冷却至100℃以下,得到过氧化钠成品。其反应式:

2.可用金属钠氧化法。 Na2O2的制备分为两步。首先用金属钠在一个含氧量低于空气的氛围中氧化成氧化钠,然后再将氧化钠在含氧量比空气高的氛围中,加热200~350℃进一步氧化成 Na2O2。欲氧化彻底,第二次氧化前,先将Na2O充分粉碎。但必须隔绝湿气。
3.将0℃的试剂氢氧化钠饱和溶液与42%的过氧化氢按理论配比混合,进行反应:

当沉淀不再析出后,抽滤,然后用无水乙醇和乙醚洗涤,得特别明亮的八水合过氧化钠。也可将工业品过氧化钠溶于4倍冰水中,控制温度不超过40℃,在溶液冷到0℃时析出八水合过氧化钠结晶,过滤后抽滤,并在不含二氧化碳的空气中干燥而制得八水合过氧化钠。
用途
1.用作分析试剂,如用作分解样品的碱性氧化性溶剂。
2.用做氧化剂、防腐剂、除臭剂、杀菌剂、漂白剂等。也可用于制备过氧化氢。
3.用作强氧化剂、漂白剂、去臭剂、消毒剂和防腐剂。化学工业中用于制备其他过氧化物等。
4.用于医药、印染、漂白及用作分析试剂等。[12]
安全信息
UN 1504 5.1/PG 1
氧化剂 腐蚀
S8 S27 S39 S45
R8 R35
文献
[1~12]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无





