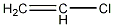
名称:氯乙烯
英文名称:chloroethylene
分子式:C2H3Cl
分子量:62.50 g/mol
标签:乙烯基氯,Vinyl chloride,脂肪族卤代衍生物
编号系统
75-01-4
MFCD00040415
200-831-0
KU9625000
1731576
24889962
物性数据
1.性状:无色、有醚样气味的气体。[1]
2.熔点(℃):-153.8[2]
3.沸点(℃):-13.4[3]
4.相对密度(水=1):0.91[4]
5.相对蒸气密度(空气=1):2.2[5]
6.饱和蒸气压(kPa):343.5(20℃)[6]
7.临界温度(℃):151.5[7]
8.临界压力(MPa):5.60[8]
9.辛醇/水分配系数:1.62[9]
10.闪点(℃):-78(OC)[10]
11.引燃温度(℃):472[11]
12.爆炸上限(%):33.0[12]
13.爆炸下限(%):3.6[13]
14.溶解性:微溶于水,溶于乙醇、乙醚、丙酮、苯等多数有机溶剂。[14]
15.Lennard-Jones参数(A):4.3387
16.Lennard-Jones参数(K):370.41
17.van der Waals面积(cm2·mol-1):4.740×109
18.van der Waals体积(cm3·mol-1):32.030
19.气相标准声称热(焓)( kJ·mol-1) :28.5
20.气相标准熵(J·mol-1·K-1) :264.08
21.气相标准生成自由能( kJ·mol-1):41.1
22.气相标准热熔(J·mol-1·K-1):53.60
23.气相标准熵(J·mol-1·K-1) :241.89
毒理学数据
1.急性毒性[15] LD50:500mg/kg(大鼠经口)
2.刺激性 暂无资料
3.亚急性与慢性毒性[16] 大鼠吸入30~40mg/m3蒸气,每天4h,5个月,20天后见心电图改变,心搏徐缓,心律不齐;4个半月后出现房室传导障碍。7900mg/m3,每天4h,每周5d,12个月,出现脑、肝、肺、肾病变及肿瘤。
TCLo:1ppm,每天4h,52周。
4.致突变性[17] 微生物致突变:鼠伤寒沙门菌2000ppm(48h)。微粒体诱变:鼠伤寒沙门菌1%。细胞遗传学分析:人Hela细胞10mmol/L。
5.致畸性[18] 大鼠孕后6~15d吸入最低中毒剂量(TCLo)500ppm(7h),致肌肉骨骼系统发育畸形。
6.致癌性[19] IARC致癌性评论:G1,确认人类致癌物
7.其他[20] 大鼠吸入最低中毒浓度(TCLo):500ppm(7h)(孕6~15d),引起胚胎毒性。小鼠吸入最低中毒浓度(TCLo):500ppm(7h)(孕6~15d),引起胚胎毒性和肌肉骨骼发育异常。
生态学数据
1.生态毒性 暂无资料
2.生物降解性[21]
好氧生物降解(h):672~4320
厌氧生物降解(h):2688~17280
3.非生物降解性[22] 空气中光氧化半衰期(h):9.7~97
4.其他有害作用[23] 氯乙烯在环境中能参与光化学烟雾反应,由于其发挥性强,在大气中易被光解,也可被生物降解和化学降解,即能被特异的菌丛所破坏,亦能被空气中的氧所氧化成苯甲醚、甲醛及少量苯乙醇。
分子结构数据
1、摩尔折射率:15.88
2、摩尔体积(cm3/mol):68.0
3、等张比容(90.2K):139.1
4、表面张力(dyne/cm):17.5
5、极化率:6.29
计算化学数据
1、疏水参数计算参考值(XlogP):1.5
2、氢键供体数量:0
3、氢键受体数量:0
4、可旋转化学键数量:0
5、互变异构体数量:
6、拓扑分子极性表面积(TPSA):0
7、重原子数量:3
8、表面电荷:0
9、复杂度:10.3
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:1
性质与稳定性
1.易燃,能与空气形成爆炸性混合物,爆炸极限3.6%-26.4%(体积分数)。遇明火、高温有燃烧爆炸的危险。有毒。在热、光及过氧化物、偶氮化物等引发剂作用下,可以本体聚合、悬浮聚合、溶液聚合及乳液聚合。可以与丙烯酸、苯乙烯等进行共聚。还可进行加成、缩合、取代等反应。
2.氯乙烯分子中的氯原子不太活泼,但在铯和其他过渡金属的存在下,可将氯迅速交换。分子中的双键在自由基引发剂存在下可以进行聚合和共聚反应。可以发生加成反应、氧化反应和热解反应。有水存在时,可以发生水解反应,形成盐酸,产生强腐蚀性。
3.稳定性[24] 稳定
4.禁配物[25] 强氧化剂
5.避免接触的条件[26] 受热
6.聚合危害[27] 聚合
7.分解产物[28] 氯化氢
贮存方法
储存注意事项[29] 储存于阴凉、通风的易燃气体专用库房。远离火种、热源。库温不宜超过30℃。应与氧化剂分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备。
合成方法


(1)乙烯低温氯化法 先向乙烯通氯,在三氯化铁存在下制取二氯乙烷,在碱的醇溶剂中,二氯乙烷再脱氯化氢制取氯乙烯,其反应如下:二氯乙烷裂解要在600℃以上进行。它除了脱第一个氯化氢生产氯乙烯外,还发生脱第二个氯化氢反应而生成乙炔,因而使氯乙烯产率降低。为了提高产率,必须使用催化剂,如活性炭、硅胶等,这样反应可以温度480-520℃下进行,氯乙烯产率可达85%。
(2)乙烯高温氯化法 以乙烯、氯气为原料,经高温氯化生产氯乙烯,同时副产多种氯代烃溶剂。整个工艺过程分热氯化、冷氯化和氧氯化三部分。其过程如下。
热氯化:乙烯、氯气和循环的二氯乙烷、三氯乙烷在热压反应釜内,于0.15MPa压力、374-495℃温度条件下反应,不用催化剂,生成氯乙烯经分离、精制而得产品,其佘二氯乙烷和三氯乙烷返回热压釜;氯化氢和未反应的乙烯送氧氯化工序。
冷氯化:使热氯化工序来的二氯乙烯与氯气反应成四氯乙烷,或与氯化氢反应得1,1,1-三氯乙烷,反应也不需要催化剂。所得四氯乙烷经热裂解而得三氯乙烯,氯化氢则送氧氯化工序。
氧氯化:以铜盐为催化剂,在0.2-0.78MPa、222-476℃温度下反应生成二氯乙烷、三氯乙烷、四氯乙烷和水,经分离得三氯乙烷、二氯乙烷产品,其佘氯代烃返回热氯化系统。
3、烯炔法 此法有两种。
(1)联合法 以乙烯、乙炔为原料,经氯化后,其中乙烯生成二氯乙烷;二氯乙烷裂解制氯乙烯,所副产的氯化氢与乙炔进行加成反应得氢乙烯,这样就可避免副产氯化氢。
该法采用的原料一半来自电石乙炔,一半来自石油乙烯。因此采用电石法生产氯乙烯的工厂,转向石油路线时,用此法作为过渡阶段比较简便,可以利用原有设备。
在国内采用重油为原料,经蓄热炉裂解,制成含乙烯25%-30%的混合气,再简易分离去除C3以上组分,制得的稀乙烯,与氯气在35-40℃、三氯化铁存在下,合成二氯乙烷。粗二氯乙烷经闪蒸精制,在管式炉内。其中副产氯化氢送往电石法氯乙烯工序合成氯乙烯。氯乙烯质量可达到聚合要求。
(2)混合烯炔法 以石脑油为原料,经2000℃的温度进行火焰裂解制得乙炔、乙烯混合气,在除去C3以上馏分和焦炭等杂质后,不经分离直接与氯化氢混合,在氯化汞催化剂存在下,乙炔与氯化氢反应生成氯乙烯,分离氯乙烯后的混合气体,通氯气与乙烯合成二氯乙烷;二氯乙烷再经热裂解得氯乙烯和氯化氢,氯化氢经提纯干燥后,送回,与混合气中的乙炔反应,用于合成氯乙烯。
裂解条件:炉温2000℃,常压,烯炔比1.2:1,烯烃产率48%-53%。氯乙烯产率:以乙炔计为95%-98%,以氯气计为99%,以乙烯计为95%-985;二氯乙烷转化率为50%,氯乙烯收率为96%。

4、电石乙炔法 以电石为原料制乙炔,在以活性炭为载体氯化汞催化剂存在下,与氯化加成而得。
配料摩尔比为:乙炔:氯化氢=1:(1.08-1.1)。乙炔和氯化氢按上述配比混合物后进行列管装有催化剂,借列管外的循环冷却水带走。反应气体中还含有未反应的氯化氢、乙炔和生成的乙醛、1,1-二氯乙烷及顺二氯乙烯、反二氯乙烯等化合物。反应后的粗氯乙烯气体,经水洗塔、碱洗塔,洗去气体中氯化氢及二氧化碳。碱洗后气体,通过干燥塔进行压缩全凝、液化,液体氯乙烯分别送入低沸点塔及高沸点塔,去除高、低沸点物即得聚合级氯乙烯单体。消耗定额(kg/t):乙炔429,氯化氢680,氯化汞2。
用途
1.主要用以制造聚氯乙烯的均聚物和共聚物。也可与乙酸乙烯酯、丁二烯等共聚,还可用作染料及香料的萃取剂。用作多种聚合物的共聚单体,塑料工业的重要原料,也可用作冷冻剂等。
2.塑料工业的重要原料,主要用于生产聚氯乙烯树脂。与醋酸乙烯、偏氯乙烯、丁二烯、丙烯腈、丙烯酸酯类及其他单体共聚生成共聚物,也可用作冷冻剂等。
3.主要用于制造聚氯乙烯。也可与乙酸乙烯酯、丁二烯、丙烯腈、丙烯酸酯、偏氯乙烯等共聚,制造胶黏剂、涂料、食品包装材料、建筑材料等。还可用作染料及香料的萃取剂。
4.用作塑料原料及用于有机合成,也用作冷冻剂等。[30]
安全信息
UN 1086 2.1
很易燃 有毒
S45 S53 S36/S37
R11 R12 R45 R23/24/25 R39/23/24/25
文献
[1~30]参考书:危险化学品安全技术全书.第一卷/张海峰主编.—2版.北京;化学工业出版社,2007.6 ISBN 978-7-122-00165-8
备注
暂无






