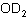
名称:水
英文名称:Water
分子式:H2O
分子量:18.02 g/mol
标签:无机溶剂
编号系统
7732-18-5
MFCD00011332
231-791-2
ZC0110000
2050024
24901995
物性数据
1. 性状:无色、无嗅的液体。
2. 密度(g/mL 20ºC):0.9982
3. 熔点(ºC):0
4. 沸点(ºC,常压):100
5. 折射率(20ºC):1.33298
6. 沸点(ºC,5.2kPa):未确定
7. 运动黏度(mm2/s,20ºC):1.0019
8. 蒸发热(KJ/mol):44.23
9. 熔化热(KJ/mol):6.01
10. 生成热(KJ/mol,25ºC,气体):-241.99
11. 生成热(KJ/mol,25ºC,液体):-286.02
12. 比热容(KJ/(kg·K),20ºC,定压):4.18
13. 蒸气压(kPa,20ºC):2.34
14. 临界温度(ºC):374.2
15. 临界压力(KPa):22.1
16. 沸点上升常数:0.515
17. 电导率(S/m,25ºC):5.89×10-8
18. 热导率(W/(m·K),30ºC):0.62802
19. 体膨胀系数(K-1,20ºC):0.000207
20. 溶解性:水对各种物质都具有亲和性。
毒理学数据
无毒
生态学数据
分子结构数据
暂无
计算化学数据
暂无
性质与稳定性
化学性质:水在电解时分解为氢和氧。常温下能与金属钠、钙等发生反应,放出氢气。与非金属氧化物(如SO3等)化合生成含氧酸(H2SO4),与金属氧化物(如CaO等)化合生成碱[Ca(OH)2]。与酯、酰胺等作用发生水解。水本身部分发生电离,电离平衡为[H+][OH-]=K[H2O]≡Kw。Kw为水的离子积,22℃时为1.00×10-14。水中氢离子浓度的负对数值称为pH值,pH=7为中性,7以下为酸性,7以上为碱性。
水具有氢键结构和很大的介电常数,因此水对各种物质都具有亲和性,能形成弱的键,称为水合作用。水合的原因是由于水分子偶极的定向移动而形成的静电水合和氢键水合。对于过渡金属离子,则由氧原子配位形成如[Cr(H2O)6]3+一样的水合络离子。由于水具有显著的水合作用,介电常数大,使得异性离子间的静电引力减弱,因此水是无机盐类的优良溶剂。水对分子量较小的烃类,特别是苯一类芳香烃溶解能力小。苯在水中溶解时自由能变化值为正(18℃,17.04KJ3/kg),焓的变化为零,且溶解度随温度的升高而减小。因此,烃类在水中溶解时熵值变化为正,即含有憎水基团的烃类分子难溶于水。这不是因为烃类与水的相互作用小,而是在憎水基团的周围水的氢键进行非常有规则的排列(称为“冰山”,iceberg)之故。这种“冰山”的形成也可称为憎水性结构的水合作用。过量的烃在水面形成油滴,如果含有某些亲水性基团(COOH、OH、NH2等极性基团)时,则可以在水面上扩散开。即在1个分子中含有亲水性基团和憎水性基团时,在水空气表面上倾向于聚集,从而使水的表面张力降低。含有较大的憎水性基团的称为表面活性剂。其水溶液在一定的浓度范围内如50~100个分子时,在憎水基团内侧和亲水基团外侧相互发生缔合,形成所谓胶束。
水还可以使各种胶体状物质浮游分散。大多数无机物都可以形成憎水性胶体。憎水性胶体之所以稳定是由于其表面具有电荷,加入少量电解质时使表面电荷被屏蔽而凝聚。添加的电解质的效果,随着与粒子电荷符号相反的离子价数的增高而增大(Schultz Hardy定律)。另一方面,亲水性胶体主要是具有高分子电解质等亲水性基团的有机物。在其周围具有发达的水合层,添加少量的电解质并不发生凝聚,只有加入大量的电解质时才能发生去水合作用,称为盐析。盐析作用的强度由去水合的强度而决定。阴离子的顺序是柠檬酸盐>酒石酸盐>硫酸盐>乙酸盐>盐酸盐>硝酸盐>氯酸盐,阳离子的顺序是Li+>Na+> K+>NH4+>Mg2+,称为Hofmeister序列。
大多数溶剂中都含有水,因此在精制时进行脱水操作是很重要的。含有多量的水时可用分馏法除去,但通常采用共沸蒸馏法脱水。甲醇与水不形成共沸混合物,用分馏精制可达到含水量在7.86~13.1mg/m3左右。乙醇形成其含量为96%的共沸混合物,共沸点78.174℃,和乙醇的沸点78.325℃非常接近不易分离。此时可加入苯以形成共沸点为64.86℃的三元共沸混合物,则容易除去水分,使水的含量在0.01%以下。微量的水用脱水剂除去,常用的脱水剂有氢氧化钙、高氯酸镁、氯化钙、金属钠、硅胶、分子筛等。
贮存方法
2-8℃
合成方法
制备纯水的方法主要有蒸馏法和离子交换法。
将自来水直接蒸馏可获得一般实验所需的蒸馏水。对于重要的物理化学和分析化学实验,通常采用二次或三次蒸馏水,这种蒸馏最好在石英装置中进行,所得的纯水应收集在耐高温玻璃、石英或聚乙烯瓶中。
为了除去水中的有机杂质和NH+4与Cl-,最好在每升被提纯的水中加入0.05g KMnO4,半小时后加入0.5~1g钾明矾,再过半小时后加入0.66g Na2HPO4,静置半小时后过滤,滤液煮沸10min后再加入蒸馏瓶中进行蒸馏,除去馏出物开头和最后的馏份(各10%)。
离子交换法是制备高纯度水的更好方法。离子交换树脂分为阳离子交换树脂和阴离子交换树脂,两种树脂在装柱前分别进行预处理。阳离子交换树脂先用自来水反复漂洗除去其中的色素、水溶性杂质及其他夹杂物,直至水清无泡沫,并用纯水浸泡4h。然后用5%的盐酸溶液浸泡树脂(以没过树脂为宜)4h,适当搅拌,将盐酸排尽后以纯水反复洗至近中性为止。阴离子交换树脂同样用水反复漂洗直至水清无泡沫,并用纯水浸泡4h。再用5%氢氧化钠溶液浸泡4h,适当搅拌,然后将氢氧化钠溶液排尽,以纯水反复洗至近中性为止。处理好的树脂装入准备好的有机玻璃交换柱中,交换流程按阳离子交换柱阴离子交换柱混合树脂交换柱(阳、阴离子交换树脂充分混匀)的顺序设定。控制一定流速向交换柱中通入蒸馏水(或自来水),从混合树脂交换柱中流出纯水,当水质达到要求后即可使用。用途
1.地表水:质量标准中Ⅰ类主要适用于源头水、国家自然保护区;Ⅱ类主要适用于集中式生活饮用水地表水源地一级保护区、珍稀水生生物栖息地、鱼虾类产卵场、仔稚幼鱼的索饵场等;Ⅲ类主要适用于集中式生活饮用水地表水源地二级保护区、鱼虾类越冬场、洄游通道、水产养殖区等渔业水域及游泳区;Ⅳ类主要适用于一般工业用水区及人体非直接接触的娱乐用水区;Ⅴ类主要适用于农业用水区及一般景观要求水域。
2.地下水:质量标准中Ⅰ类主要反映地下水化学组分的天然低背景含量。适用于各种用途。Ⅱ类主要反映地下水化学组分的天然背景含量。适用于各种用途。Ⅲ类以人体健康基准值为依据。主要适用于集中式生活饮用水水源及工、农业用水。Ⅳ类以农业和工业用水要求为依据。除适用于农业和部分工业用水外,适当处理后可作生活饮用水。Ⅴ类不宜饮用,其他用水可根据使用目的选用。
3.海水:质量标准中第一类适用于海洋渔业水域,海上自然保护区和珍稀濒危海洋生物保护区。第二类适用于水产养殖区,海水浴场,人体直接接触海水的海上运动或娱乐区,以及与人类食用直接有关的工业用水区。第三类适用于一般工业用水区,滨海风景旅游区。第四类适用于海洋港口水域,海洋开发作业区。
4.生活饮用水:供人生活的饮用和生活用水
5.电子超纯水:用于电子元件及集成电路
安全信息
暂无
暂无
暂无
暂无
文献
暂无
备注
暂无







